Д-р Р. Станиславов, В. Николова
Андрологична лаборатория, Спешна урология
УМБАЛСМ „Н.И.Пирогов”, бул.”Тотлебен” 21, 1606 - София
Спермалният анализ предоставя изчерпателна информация за репродуктивната функция на мъжкия фактор в субфертилната двойка. Той включва определяне на сперматозоидния брой, чрез който се изследва (сперматозоидното производство, транспорта през мъжкия генитален тракт и еякулаторната функция), сперматозоидния мотилитет (основен функционален маркер за вероятна способност сперматозоидите да оплождат), сперматозоидния виталитет (за да се направи разграничение между мъртвите и живи, но неподвижни сперматозоиди), сперматозоидната морфология (аспекти на сперматозоидната продукция и съзряване) и обема на еякулата (продукция на семенната течност, като съвкупност от секретите на допълнителните полови жлези). Освен основните изследвания на семенната течност има и други тестове, които могат да бъдат проведени, които се наричат разширен спермален анализ, позволяващ по-детайлна оценка на функционалните аспекти на спермалната проба.
Изчерпателната оценка на спермалното качество е не само основата при диагнозата на мъжкия инфертилитет, но също така дава важна прогностична информация, касаеща инфертилната двойка. При оценката на оплодителната способност на мъжа поетапно, е важно да бъдат използвани точни методи с качествен контрол (QC), качествено осигуряване (QA) и подобряване на качеството (QI). Прилагането на такива методи ще доведе до значително подобрение в качеството на данните, получени от андрологичната лаборатория и следователно, по-точна клинична информация.
Човешкият сперматозоид – клетка пратеник
Сперматозоидът е клетка пратеник предаващ информация, носещ уникално съобщение от бащата за създаването на здраво дете и последващо здраво поколение при двойката. Като пратеник, той се нуждае от специални качества, като например да бъде подвижен, за да достигне неподвижната яйцеклетка и да предостави своята информация след фузия с ооцитната мембрана. Подвижността на сперматозоида зависи от аксонемалната структура (микротубулните дублети, динеиновите ръчички, спиците), наличието на функционални митохондрии и функционални външни плътни фибри, и двете предоставящи енергия (АТФ), функционална центриола (вмъкването на опашката) и фиброзна обвивка на опашката (устойчиви движения на опашката).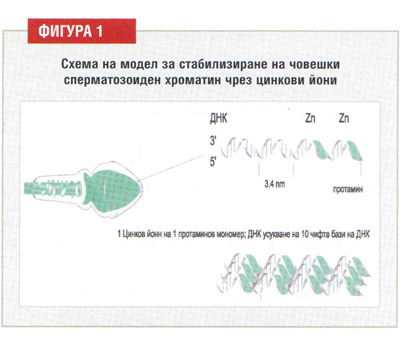
ДНК в сперматозоидите е временно добре запазена, протектирана в полукристална структура и стабилизирана чрез цинк (фигура 1). Това уникално плътно пакетиране на сперматозоидния хроматин създава защита и може да компенсира липсата на възстановителна система за ДНК. Сперматозоидният хроматин първично е подреден като “въже” с три взаимно усукани вериги: двете ДНК вериги, изградени от две нишки, докато третата нишка е изградена от протамини. Има по един цинков йон за всяка една протаминова молекула и завъртване на ДНК спиралата, т.е. за всеки 10 чифта бази на ДНК. Извличането на цинка улеснява бързото разплитане на хроматина в отделни ДНК нишки (двойно-верижни спирали), когато бъдат изследвани почти незабавно след еякулация. Тази възможност бързо намалява, след като сперматозоидите попаднат във втечняващ се еякулат in vitro.
Това уникално плътно пакетиране на сперматозоидния геном се дължи на заместването на свързаните с ДНК хистони в ядрото. По време на късната фаза на спермиогенезата, соматичните хистони се заместват първо от временни транзиторни протеини, а след това от протамини. В същото време цинкът се инкорпорира в сперматозоидното ядро. Положителните аминогрупи (-NH3+) на аргинина в протамините неутрализира отрицателните фосфатни групи (-PO43-) на ДНК гръбнака, който е основа за здраво пакетиране на ДНК – протаминовия комплекс. Освен аргинин, тези протамини съдържат аминокиселините цистеин и хистидин, които образуват стабилни временни солеви връзки с цинка. Освен това, наличието на цинк улеснява свързването на ДНК с протамините. Дефицитът на цинк в сперматозоидното ядро предизвиква in vitro свободни сулфхидрилни групи, които образуват дисулфидни мостове и следователно, се променя типа на хроматиновата стабилност от цинк-зависима в цинк-независима хроматинова стабилност, причинена от дисулфидни мостове, водещо до абнормална (ковалентно свързана) и по-лесно възстановима стабилизация на хроматина. Това е вероятната причина да затрудни или поне да забави сперматозоидната хроматинова декондензация в ооплазмата и което следователно, е една важна причина за инфертилитет при мъжа.
Последователност на еякулацията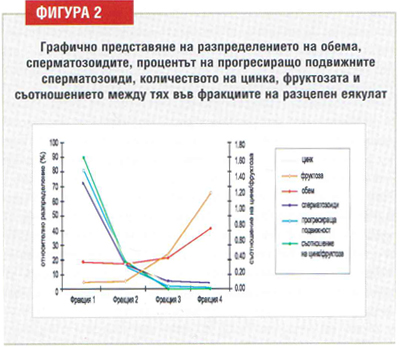
Нашето познание за нормалната еякулаторна последователност идва от изследвания, използващи разцепени еякулати (split ejaculate). При еякулация всяка фракция се получава и характеризира чрез изброяване на сперматозоидите и определяне на секреторните маркери: на простатата (цинк) и на семенните мехурчета (фруктоза). Такива изследвания разкриват, че сперматозоидите от дисталната част на опашката се суспендират в едновременното отделяне на течност от простатните жлези и се изхвърлят в първата еякулаторна порция: физиологичният еякулат, който се депозира срещу цервикалната слуз е съставен от сперматозоиди в простатна течност. Малко след това се изхвърля течност от семенните мехурчета, която съдържа по-ниска концентрация на сперматозоиди с по-лоша морфологична характеристика (фигура 2).
Еякулаторна последователност, еякулатен състав и сперматозоиден хроматинов стабилитет
Силите, които нормално стабилизират сперматозоидния хроматин очевидно имат съществено значение за сигурния транспорт на генетичния материал до ооцита. Фертилни донори, както е установено, имат по-високо съдържание на цинк в сперматозоидния хроматин, в сравнение с инфертилни мъже и около 25% от инфертилните мъже имат нарушен стабилитет на хроматина. Извличането на цинка спомага за бързото деструктуриране на цялото ядро до отделни нишки, когато се изследва минути след еякулация. Тази способност бързо намалява, когато сперматозоидите се съхраняват in vitro. Съставки от семенните мехурчета могат да лишат сперматозоидния хроматин от цинк, повлиявайки нормалното защитно пакетиране на сперматозоидната ДНК. Шансът за постигане на бременност чрез IVF е силно намален сред мъже с ниска концентрация на цинка в семенната течност.
“Стандартизираните” методи за спермален анализ и обработване на сперматозоидите
На практика, стандартна спермална проба съществува само в лабораторията, когато цялото количество еякулат се получава и се смесва в един съд. От физиологична гледна точка стандартната спермална проба е един артефакт, която форсира сперматозоидите в простатната течност да бъдат уловени в капана, след попадането в семенно-мехурчестия гел, до обикновено 20-та минута. PSA от простатата разгражда гел-образуващите семиножелини от везикуларен произход. Поради този процес и главните условия през време на in vitro процедурите, сперматозоидите биват изложени на въздействието от страна на нарастващия осмоларитет, нарастващото налягане на кислорода и повишените нива на свободни радикали.
Изследване на семенна течност
Тестове за сперматозоидо-цервикално мукусни взаимоотношения
При естествен начин на зачеване (in vivo), сперматозоидите трябва да бъдат депозирани на мястото на инсеминация (около външния цервикален отвор) през време на периовулаторния период, когато цервикалната слуз допуска пенетрация на сперматозоидите. Пенетрацията на сперматозоидите в цервикалната слуз, последвано от тяхната миграция през мукусното стълбче в цервикалния канал, е една съществена крачка в сложната серия от явления, чрез които сперматозоидът преминава 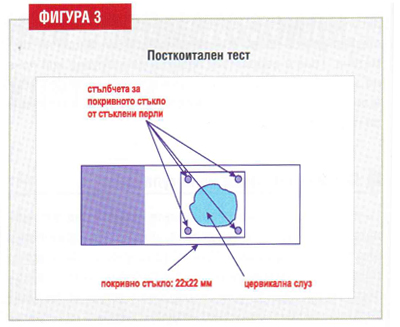 женския тракт и достига мястото на оплождане в ампулата на яйцепровода. Оценката на сперматозоидо-цервикално мукусните взаимоотношения следователно е неразделна част от диагнозата на инфертилната двойка и най-честите методи, които се използват са описани по-долу. Те са разработени и приложени в практиката, следвайки ръководствата на СЗО, 1980, 1987, 1992, 1999 и последното V-то ръководство, 2010.
женския тракт и достига мястото на оплождане в ампулата на яйцепровода. Оценката на сперматозоидо-цервикално мукусните взаимоотношения следователно е неразделна част от диагнозата на инфертилната двойка и най-честите методи, които се използват са описани по-долу. Те са разработени и приложени в практиката, следвайки ръководствата на СЗО, 1980, 1987, 1992, 1999 и последното V-то ръководство, 2010.
In vivo теста за сперматозоидо-мукусното взаимоотношение е „пост-коитален тест” (PCT), който изисква получаването на проба цервикална слуз няколко часа след полов контакт, проведен през пери-овулаторния период и изследван за наличие на сперматозоиди. Тъй като клиничната стойност на PCT дълго време беше оспорвана, сега може да се каже, че този тест предоставя информация с прогностична стойност за фертилитета (фигура 3).
Тестовете in vitro за сперматозоидо-мукусно взаимоотношение се разделят на 2 класически метода: „тест върху предметно стъкло”, използвайки подходяща капка семенна течност и цервикална слуз под покривно стъкло; и „ тест с тръбичка” (тест на Kremer), където напълнени с цервикална слуз капилярни тръбички се поставят с единия си край в контакт с втечнена семенна течност. Пенетрацията в която и да е система се оценява чрез преброяването на подвижните сперматозоиди на различни дистанции от сперматозоидо-мукусната граница за различно време след осъществяване на съответния контакт.
За физиологичната и клинична значимост, тестовете трябва да се провеждат през пери-овулаторния период, когато слузта допуска пенетрацията на сперматозоидите. Експериментите доказват, че резултатите, получени при жени, лекувани с естрогени, цервикалната слуз по-лесно допуска сперматозоидната пенетрация, но включването на такава терапия в рутинното изследване на инфертилната двойка е нежелателно в ерата на АРТ.
Слузта трябва да се взима от цервикалния канал, без да се контаминира с вагинално съдържание; слузта трябва да отговаря на скора на Insler ≥10/15т. и рН ≥7.0. Трябва да бъде спазен 3 дневен период на полово въздържание от страна на мъжа преди теста (in vivo или in vitro), за да се получи оптимална спермална характеристика и да не се отчитат сперматозоиди от предишни полови контакти. Трябва да бъде проведен пълен спермален анализ на еякулата, използван за теста на Kremer. Ако въздържанието при мъжа не е 3 дни, теста трябва да бъде отложен, като тръбичката с цервикална слуз може да бъде съхранена при 4ºС за 2-3 дни.
Както при всичките тестове за сперматозоидна функция, сперматозоидо-мукусния тест трябва да стартира, по възможност веднага след еякулация. Нормално, спермалната проба се втечнява до 30 минути, което е идеалното начало за провеждане на теста. Ако втечняването се забави, тестът трябва да се отложи, защото пенетрационната способност в цервикалната слуз може да бъде понижена поради по-продължителното въздействие на спермалната плазма върху сперматозоидите. Макар че спермалната плазма е важна за сперматозоидната пенетрация в цервикалната слуз, сперматозоидният мотилитет и виталитет значително намаляват при по-продължително въздействие.
 Тестове за определяне на сперматозоидна ДНК фрагментация и избор на метод за приложение в рутинната диагностика
Тестове за определяне на сперматозоидна ДНК фрагментация и избор на метод за приложение в рутинната диагностика
Анализът на сперматозоидната ДНК фрагментация е нов важен параметър за оценка на спермалното качество. Използването на методи като TUNEL, COMET, SCSA или не са възпроизводими, или са относително скъпи. Методът TUNEL изисква флуоресцентна микроскопия или флоуцитометрия и не е специално предназначен за човешки сперматозоиди. Методът COMET е технически сложен и трудоемък, и не е приложим в рутинната практика. Най-разработеният и използван метод е SCSA, но той изисква скъпо оборудване (флоуцитометър) и не e приложим за работата в андрологичната лаборатория, където рутинно се извършва разширен спермален анализ.
Като възможен метод, приложим в лабораторната практика е SCD метода, разработен и стандартизиран като Halosperm kit®. SCD метода е специфично предназначен за изследване на човешки сперматозоиди и за разлика от другите методи, съществува само един стандартен протокол, от който зависи неговата висока възпроизводимост. SCD метода е технически лесен и бърз, особено ако се използва SCA софтуеърната система, където автоматично се определя размерът на „ореола”, чрез дигитален анализ на образа. Halosperm kit® може да се приложи във всяка андрологична лаборатория, тъй като е стандартизиран, лесно приложим, възпроизводим и бърз, и може да се отчита и със светлинна микроскопия.
Предимството на използването на софтуер за определяне на ДНК фрагментацията е, че отчитането на минимум 200 клетки по отделно става бързо и точно, и също така заложената големина на „ореола” метрично разграничава сперматозоидите с ДНК фрагментация от тези без ДНК фрагментация.
Компютърна микроскопска флуоресцентна работна станция (Sperm Class Analyzer, SCA®v.5.0)
SCA е система, която позволява автоматичен анализ с възможност за едновременно и контролирано от специалист провеждане на изследването (визуализация на анализирания образ, отстраняване на артефакти, изключване на анализирано поле със значителна разлика, в сравнение с останалите, изследване на достатъчен брой сперматозоиди, по преценка на специалиста, възможност за външен лабораторен контрол, архивиране на данните и др).
Възможностите на този клас анализатор да извършва морфометрични анализи, както и дигиталния анализ на образите, го отличават от CASA системите, където контролът на изследователя е сведен само до поставяне на пробата в апарата, без възможност за достъп до картината и намеса при необходимост, от където резултатът се натоварва с грешки.
Нашият опит показва, че мануалния спермален анализ е по-надежден пред CASA, при спазване на изискванията на СЗО, като използване на стандартни криви за качествен контрол и избягване на  източниците на грешки, за получаване на достоверни резултати.
източниците на грешки, за получаване на достоверни резултати.
Морфометричният анализ, особено при определяне на сперматозоидната морфология, където измерването изисква точност до десета от микрона, за предпочитане е използването на автоматизирана система, която ще изследва с една и съща точност всеки един от анализираните 200 сперматозоида. SCA системата ни дава и двете: прецизната компютърна морфометрична оценка и успоредно с това – решаващата преценка на изследователя с дългогодишен опит (фигура 4). Например, при компютърна оценка на даден сперматозоид за „нормален”, по отношение на глава и средно парче, анализаторът е този, който ще потвърди резултата, или ще го отхвърли (при наличие на опашен дефект).
Чрез SCA станцията и наличие на софтуеърен модул, имаме възможност за провеждането на тест за жизнеспособност на сперматозоидите (DUO-VITAL кит), тест при който се използват два флуорохромни оцветителя и чрез флуоресцентна микроскопия и едновременно визуализиране, ние отчитаме дигиталния анализ на образа. Този тест корелира с теста за виталитет: еозин/нигрозин (светлинна микроскопия), но отваря нов широк диапазон от възможности при отчитане на дигиталния образ. Наблюдаваме сперматозоидни ядра, оцветени в зелено и други – в червено.
Високата разделителна способност на флуоресцентната микроскопия ни дава въжможност да наблюдаваме и трети вид оцветени сперматозоидни ядра, оцветени едновременно с двете бои (на места в жълто), които са живи, но в състояние на апоптоза. Тези сперматозоиди при светлинна микроскопия могат да бъдат класифицирани като живи, подвижни, но чрез DUO-VITAL теста ние ги отчитаме като мъртви, тъй като са програмирани да умрат и протоколът изисква отчитането на сперматозоид със зелено-червено ядро да бъде в графа "мъртъв".
В заключение, възможностите за по-детайлна и прецизна диагностика на мъжкия фактор, както и провеждане на тестове за сперматозоидо-цервикално мукусни взаимоотношения ще допринесе за по-точна клинична оценка на безплодието при двойката.
Повече за Андрологична лаборатория в УМБАЛСМ "Пирогов":
*Описателните графики включени в тази статия принадлежат на сп. MEDINFO






